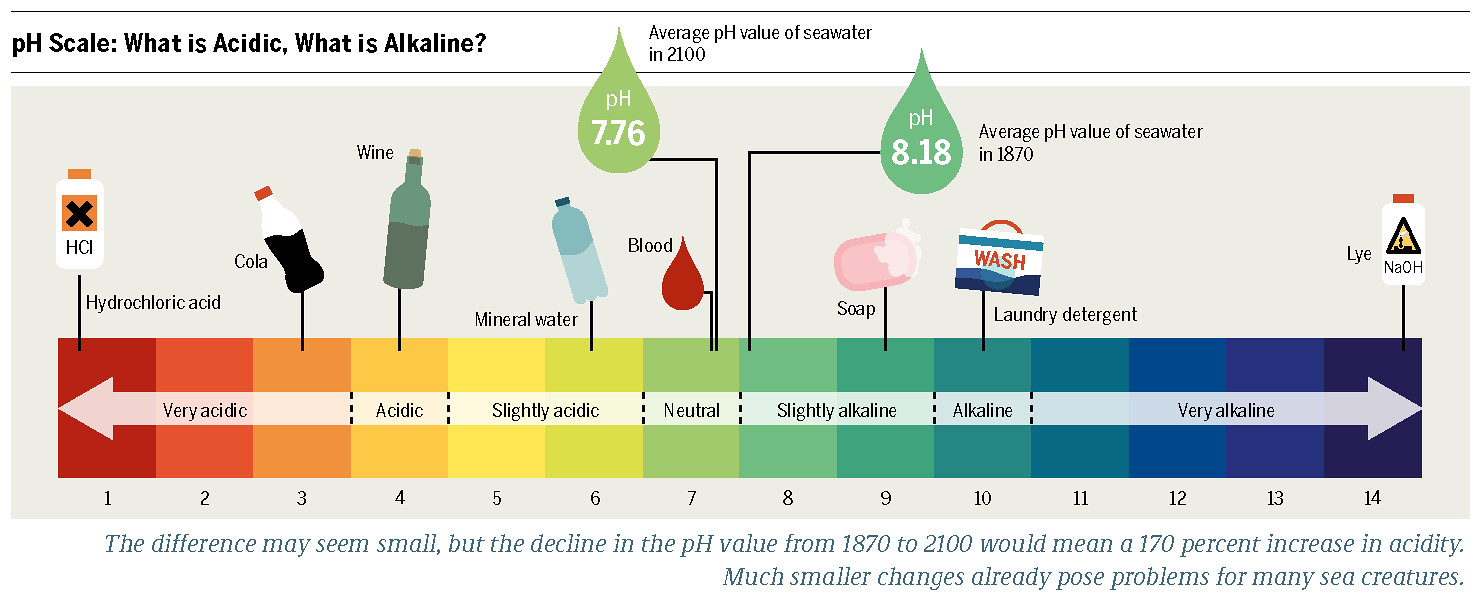
pH 척도 ⓒ Heinrich-Boll-Stiftung [CC BY-SA 2.0]
산성(pH)
pH는 수소 이온 농도 지수를 말한다. pH는 물질의 산과 염기의 강도를 나타내는 척도로 pH 7이 중성이며, 일부 초강산이나 초강염기 물질을 제외하면 pH 값의 범위는 0에서 14 사이이다. pH 값이 클수록 수소 이온 농도가 낮고 염기성이며, 반대로 pH 값이 작을수록 수소 이온 농도가 높고 산성이다. pH는 수소 이온의 농도의 역수에 로그를 취한 값으로 pH 값 1이 하락하면 수소이온농도 값은 10배 증가한다.
바닷물에 녹아있는 여러 염이온으로 인해 바다는 약한 알칼리를 띠고 있다. 바닷물의 pH는 산업시대 이전에는 평균 8.2 정도였지만 지금은 평균 8.1 정도 된다. 이는 매우 작은 차이로 보이지만, 실제로 수소이온농도는 약 30% 증가했다.
순수한 물은 중성이지만, 대기 중에 있는 이산화탄소가 녹아 pH 5.7 정도의 약산성이 된다. 이를 화학에서는 평형이라고 부르는데, 바닷물 또한 대기의 이산화탄소를 평형 상태에 이를 때 까지 흡수하거나 방출한다. 인간의 활동으로 인해 대기 중 이산화탄소 농도가 증가하면서 평형이 맞지 않게 되면서 바다는 대량의 이산화탄소를 흡수해오고 있다.
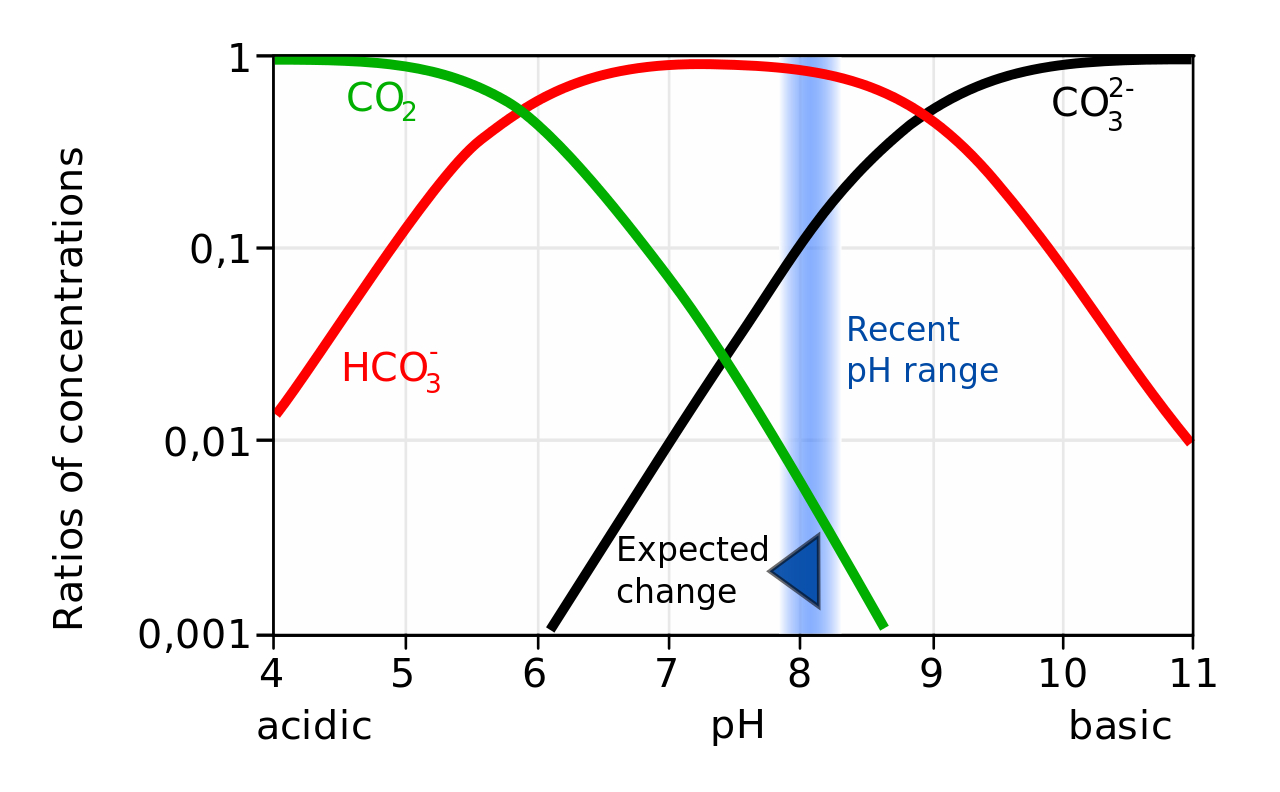
이산화탄소와 탄산염, 중탄산염의 화학적 균형, public domain
바다에 대량의 이산화탄소가 녹아들어도 바다는 어느정도의 pH를 유지하고 있다. 이는 바다가 완충 능력을 가지고 있기 때문이다.
$CO_{2}(aq) + H_{2}O \Longleftrightarrow H_{2}CO_{3}$
: 물에 녹아든 이산화탄소 중 일부는 물과 반응해 탄산이 된다.
$H_{2}CO_{3} \Longleftrightarrow HCO_{3}^{-} + H^{+}$
: 탄산 중 일부는 다시 중탄산염과 수소 이온이 된다.
$HCO_{3}^{-} \Longleftrightarrow CO_{3}^{2-} + H^{+}$
: 중탄산염 중 일부는 다시 탄산염과 수소 이온이 된다.
위의 그래프에서 보듯이 물에 녹아든 이산화탄소와 중탄산염, 탄산염의 농도는 평형을 이루고 있다. 이 알칼리염들이 물에 녹아든 이산화탄소에서 나오는 수소 이온을 중화해서 pH가 극적으로 변하는 것을 막고 있다. 탄산염은 칼슘 이온과 결합해 탄산칼슘이 되어 해양 생물의 골격 형성 등에 쓰이는데, 바다가 점차 산성화되면, 탄산염의 농도가 줄어들면서 탄산칼슘의 생성이 어려워지고, 반대로 탄산칼슘이 바다에 녹아드는 현상이 발생할 수 있다.